粗製苛性ソーダ液の濃度をクエン酸で決める
(1) pH試験紙で中和点を調べる
Part (2)へ Workbenchへ|
<自宅で作った苛性ソーダの濃度を知りたい> 重曹(炭酸水素ナトリウム, NaHCO3, 料理などでよく使います)と生石灰(酸化カルシウム, CaO, 海苔など食品用の乾燥剤)を原料として苛性ソーダ(水酸化ナトリウム, NaOH) を作りました(ここ)。 確かにアルミニウムを溶解し、水素を発生したのでかなり濃い NaOH 溶液ができたのは確かですが、濃度は不明でした。 NaOH はアルカリ性なので酸で滴定して決めるというのが普通の発想です。ビュレット(細いメスシリンダーにコック栓がついた器具)と指示薬(フェノールフタレインなど)を使いますが、使ったあとどうするか頭を悩ませことになります。捨てるのはもったいないし。 そこでHWBにふさわしい方法で濃度を推定しようと思います。 | <クエン酸で中和させる> NaOH溶液の中に粉末クエン酸を少しずつ加えていき、pHのグラフから中和点を推定することにします。体積は一定とみなせるので酸濃度を徐々に増していくことになります。そこで次のような段取りで実験します。以下、「pHをチェック」とは、pH 試験紙を浸して引き上げたあと、色から pH を読み取る作業のことです。
|
| <試験液の pH チェック> 試験液に浸したpH試験紙をスケールと比較するとpH はおよそ 11です。原液の濃度はおよそ 50×10-(14-11)mol/L=50 mmol/L と推定されます。しかし、実際はもっと濃いことが次で分かります。 
他の濃度でのpHチェック結果を、一部ですが下に載せます。 | <pH をクエン酸濃度に対してプロットすると> 150 mg/50 mL=16 mmol/L のクエン酸で中和されているのでNaOH試験液の濃度はおよそ4.8 mmol/Lです。 よって NaOH原液の濃度は約 2.4 mol/L と推定できます。誤差を考慮すると約2 mol/L というべきでしょう。測定点はゆるやかにpH=7の線を横切っていますが、測定誤差によるものと思われます(Part 2)。 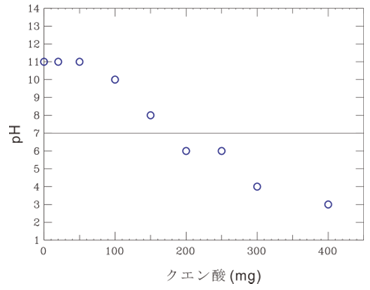
|
|
<中和点付近の pH チェック>
クエン酸が 100, 150, 200 mg と増えると pH は 10, 8, 6 と減少します。 
| |